; y; v* u$ C9 P0 O据ISO官网消息显示,ISO 13485:2016标准于3月1日正式生效!ISO13485即《Medical device - Quality management system -requirements for regulatory purpose》是由ISO/TC210医疗器械质量管理和通用要求技术委员会制定,应用于医疗器械行业,在法规目的要求下运行的独立标准。现就新版ISO13485的换版情况进行介绍。
6 t8 J v& Z- s* K0 I1 Q/ X% M
2 j; x+ M# w* G# f1新版本进展
% o! Y0 {1 X0 {' w1 [2014.2,ISO 13485:201X(DIS.1)发布
2015.2,ISO 13485:201X(DIS.2)发布
2015.5,ISO 13485:201X(DIS.2)评审期结束
2015.6,ISO/TC 210在美国会谈,对DIS.2的评论意见进行讨论并形成决议
2015.10.29,ISO 13485:201X(FDIS)发布, 12月29日投票通过
2016.3.1,ISO 13485:2016 新版标准正式发布
/ E7 w0 L3 ~: _
! ~2 H4 G* K$ Z( w; D! i8 i
2换版背景及过程. `! O' H( u X8 U: l# o2 l: G
自1996年以来,ISO13485首次发布, 2003年7月15日第二次改版(ISO13485:2003)发布。鉴于医疗器械市场的运行模式变化和法规协调性的要求,2011年启动了201X版ISO13485的换版工作,至2014年共收集了868个评论并对第一版DIS进行投票,由于没有达到规定要求,第一版的DIS稿被否决,理由主要是标准结构问题和法规的协调性考虑。2015年2月开始对DIS第二稿进行了投票,5月份正式宣布通过,8月份在伦敦进行FDIS的讨论,10月发布FDIS稿进行投票,只有2个负面的投票,最终于12月29日通过投票。鉴于标准的制定规范要求,ISO13485:2016通过了60.60阶段并于2016年3月1日正式发布。
1 I/ m4 |; _" Z. @$ r
3主要变化
" Z, \( i: n" w0 x" T根据目前第三版ISO 13485医疗器械质量管理体系的要求来看,重要的变化是导入了生命全周期的基调,贯穿了产品设计开发、生产、储存、安装、服务和废弃处置等每一个环节。
5 c7 F8 l9 ]5 P具体的变化包括如下:
, x8 X9 ? i& o" W4 O6 b- p* m1、适用的范围更明确
新版对产品储存和分销,内外部供应商服务,甚至是相关服务进行了适用性明确清晰的说明。例如器械的经营商;运输服务,灭菌服务,安装和维护服务,软硬件以及零部件等供应商。
' n- ` w6 ?/ e ?; u! B2、删减的条款更合理
新版对不适用的条款进行了扩展,允许组织对第6、 7或8章的条款进行合理删减,这一变化迎合了当前的商业运营模式,体现了标准的适用性。
1 W0 M* U" Q4 k9 c3、术语和定义更实际
新版对术语进行了增加和修订,03版共有8个定义,通过对03版的定义进行了修改和删减,新版增加到14个定义,比如风险相关的定义,欧盟和美国的法规的有关术语和无菌产品要求的术语等,例如临床评价、生命周期、制造商、进口商、经销商、授权代表、性能评价、投诉、上市后监督、风险、风险管理等专业术语。
r' P* T8 g5 S; \
4、风险管理更趋强化
新版更明确了风险管理的要求,提到“风险”和“风险管理”共20处,提出了对供应商风险的控制,进一步细化了医疗器械风险、反馈机制、投诉处理和数据分析,使上市后的风险监控体系更加具有可操作性。
. M% t2 j8 Q$ x- N9 x5、条款的变化更合规
新版更多地考虑了法规要求全文提到“法规”就有60处之多,“法规要求”37处,突出强调满足法规要求,以确保医疗器械的安全有效,协调兼容了很多法规要求,如美国FDA QSR820、日本JPAL法规MO169、巴西GMP、欧盟F法规MDR和IVDR、加拿大和澳大利亚以及中国的法规要求,适应了更广的协调合规要求。例如,引入新的可用性(Usability)和软件应用的要求;细化了设计过程的控制;明确了变更控制要求;强化供应商控制要求;明确追溯(UDI)的要求和目的;增加有关反馈和投诉处理的要求。
从目前的内容变化来看主要是满足北美,欧盟和日本的一些国家的要求,同时也兼顾了亚洲国家医疗器械的管理的现实要求,总的来说比2003版更严格和贴近法规更具体。通过新版的标准的变化,企业需要关注配套的标准的应用。
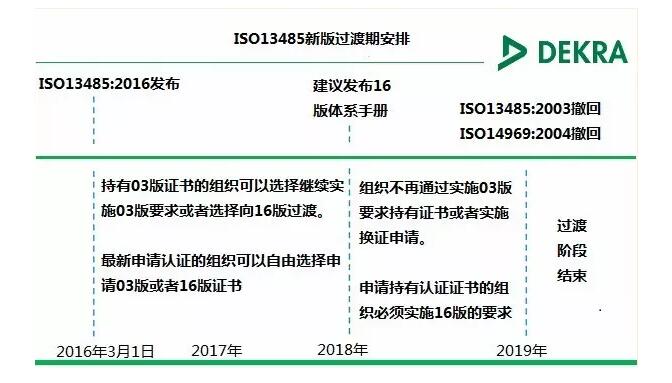
7 v# k, \; O- \& E# @) A7 ]" o7 d4过渡期安排& ~7 A: I# F* h4 L! R
目前根据讨论的要求, 2003版的ISO13485将在新标准发布后3年失效,建议在2016版2年内完成过渡期,2018年以后企业不再运行2003版的要求。具体的过渡安排见下表:
* @# c( l7 \: E1 l/ I
 # _5 Y+ I' [" v8 c; u) y4 o: w- q
' ^' o" P4 j6 J3 o5 P3 \
# _5 Y+ I' [" v8 c; u) y4 o: w- q
' ^' o" P4 j6 J3 o5 P3 \ 6 q( W) x: Y& Y" C/ g
5与QSR820主要差异
: @) R0 k2 @3 u一. 标准与法规在目的差异
. ?( q$ Z( D- yISO13485是个协调很多法规要求的自愿采纳的标准,结构上服从标准构建的指导原则要求,属于流程模式为基础,而QSR820属于美国医疗器械(成品医疗器械)的法规要求,属于规定的原则模式为基础。所以在理解ISO13485的时候以要求为核心,理解QSR的时候以规定原则为中心。故此, ISO13485 新版的对象是医疗器械及相关邻域,而QSR820针对的是功能价值导向的“成品器械”为主,ISO13485是以删减和适用为范围之理由, QSR820是以职责为基础和合规为范围之理由也就很容易理解了。
9 J; d1 U, s- B2 s
二. 标准与法规在内容上的差异
5 e7 l! H) C+ p, y
根据ISO 13485新版和QSR820的起草和修订历史来看他们的主要区别。具体的内容区别大致如下(限于篇幅,只能浅显列示):
" Q3 S6 m$ p h9 X' Y4 R: h
1)定义差别
- c( t- F2 t' f. m# |ISO13485的术语与定义部分,管理的通用部分借用ISO9001的术语和定义, 而QSR820的定义借用的是法案的术语,这样要准确理解每个术语就需要溯源,否则就存在不明白的地方,比如记录的定义不一样,QSR的记录定义要溯源到法案,这里就不一一列举。
( r8 T2 c$ W& y$ S& ^
2)管理要求上的差别
+ b$ u" G5 I1 s6 I* O+ X
ISO13485的新版的管理部分的要求与旧版的差别不算很大,新标准中对法规的前置条件和评审的细节做了主要的修订,其他部分相对较小,有些部分的改动直接来自QSR820。而QSR820对管理部分的要求更是明确到子要求,比如质量计划的要求等等。
] Z$ |6 C4 U) z/ p" s, m9 |
3)过程控制上的差异
7 T4 ~" j) q. E- q" |
ISO13485的新版的过程控制讲究风险管理,而且对所有的过程的策划都是以风险管理为基础,增加了许多对变更的控制,而QSR的过程策划是以明确定义的产品的安全和有效为基础,描述和操作上有细微区别。但本质上是一致的,QSR820 通篇只有一处提到风险分析。QSR820对设计控制中的删减是基于产品的风险等级进行了规定, 而ISO13485对设计的删减明确了职责的价值。ISO13485的要求中列示了设计验证的样本量要求,QSR820虽然没有明示这个要求,但是统计要求明确到所有过程中,而且在FDA的产品上市过程中也是必须要说清楚的一件事。关于UDI的要求,QSR820属于明确的要求,对于ISO13485的要求是考虑到协调的程度不一样,所以属于是否适用的法规要求。新版ISO13485中的要求明示了可用性的要求,QSR820虽然没有明示,但是相应的要求是存在的,并且有指南做支持的。新版对外包方的管理更加完整,QSR820对外包管理还包含了成品器械制造商的法规合规要求,新版的ISO13485关于变更控制更趋向QSR820的要求。
M8 l1 B5 U1 e+ \8 {& p2 H
4)纠正预防措施的区别
* b6 Q* [& [4 Q* X5 G$ j5 ^8 {在QSR820的纠正预防措施的要求中明确的十余种输入要求, 而ISO13485纠正措施和预防措施的输入描写不十分的具体,仅以不符合为切入点,从侧重点的来看QSR820的核心是产品的安全和有效上,所以输入部分的内容明确了产品的异常和过程的质量要求,而ISO13485的对象是以不符合为核心来思考纠正预防措施的。
, D- G$ {, R$ M' h( ]. `) T5 V
关于辅助系统的差异性不大,在这里不一一描述。
( {5 @6 n a) @' L( ]6实施参考1 Q+ I; }: X6 ~) B \
对于新版标准的实施安排,建议企业按以下步骤。先行培训,对于其中的技术要求要深入理解,如设计验证的样本量的合理性,如体系软件应用确认要求,等等。其次,进行差距分析,选择适用的标准,法规和技术支持体系的变化实施,相对来讲体系运行的支持性文件和欧美有很多的指南可以帮助企业实施体系里的要求,如统计工具的导入,如AAMI TIR 36的引入,如风险工具的选择和优化,等等。再就是进行体系改动项目计划的策划和实施,并适当进行内审和管理评审,如果有不符合要求的就采取纠正预防措施了,直至差距关闭。
总之,新标准的要求更实际,更科学,更明确,更广泛地协调了法规要求,最大限度地降低了风险,确保医疗器械的安全和性能功能的有效,为将来新技术应用和法规审核提供了更好的一致性。
e$ ^& M; C# J! j+ ^
作者单位:德凯质量认证(上海)有限公司
1 o4 a" U. |3 r$ ?: b/ C- End -